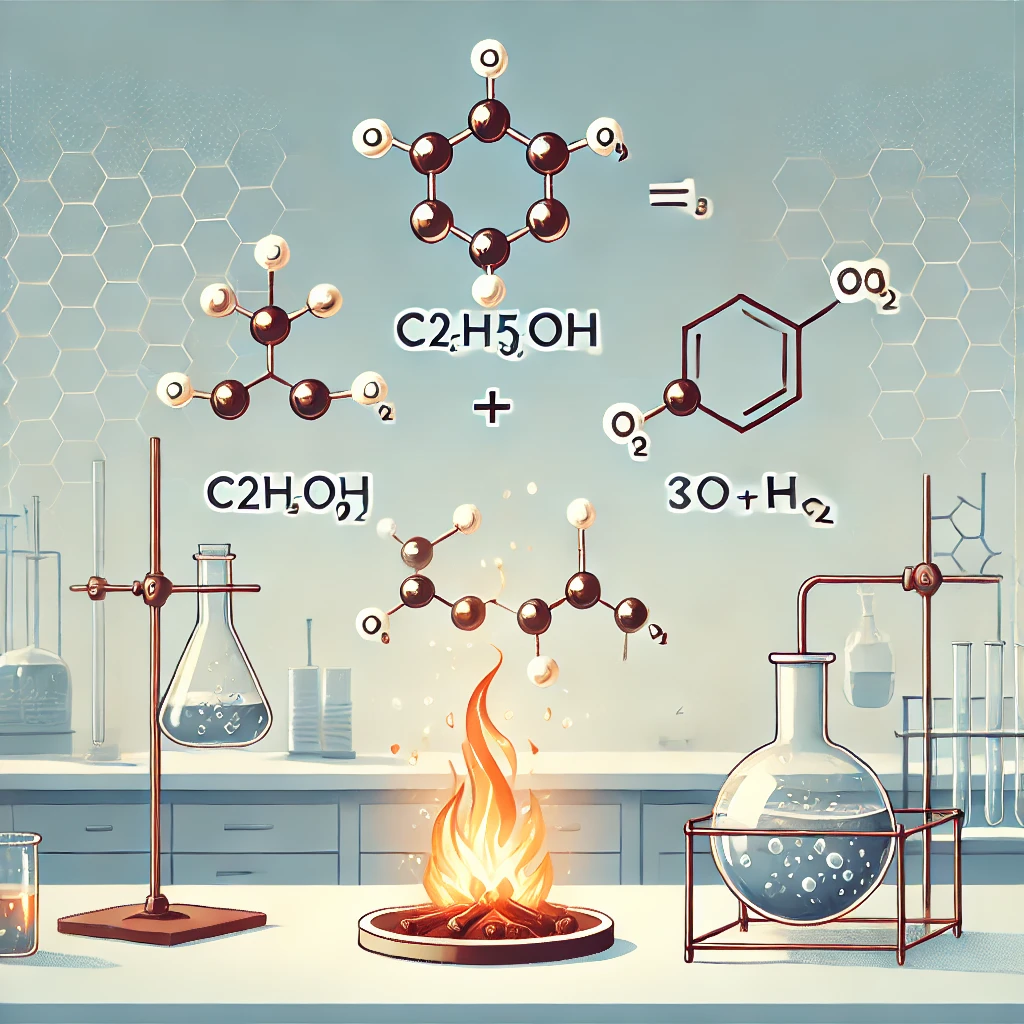
에탄올 연소 반응식 🔥
화학은 우리 주변에서 끊임없이 일어나고 있는 변화입니다. 오늘은 “에탄올 연소 반응식”을 중심으로 연소 반응의 기본 원리와 에탄올의 에너지 변환 과정을 알아보겠습니다. 이 과정은 환경과 에너지 산업에서 매우 중요한 역할을 합니다. 😊
에탄올 연소 반응식: 기본 개념 🔍
**에탄올(C₂H₅OH)**은 알코올의 한 종류로, 연료로 자주 사용됩니다. 에탄올이 연소하면 산소와 반응하여 에너지를 방출합니다. 이 과정은 화학적 변화로, 다음과 같은 반응식을 따릅니다:
C₂H₅OH + 3O₂ → 2CO₂ + 3H₂O + 에너지(열 및 빛)
이 반응은 산소(O₂)가 충분히 공급될 때 일어나는 완전연소를 나타냅니다. 🌟
에탄올 연소 반응의 메커니즘 💡
- 분자 간 상호작용:
에탄올 분자(C₂H₅OH)와 산소 분자(O₂)가 화학적으로 결합하여 새로운 화합물을 생성합니다. - 결과물:
반응의 결과로 이산화탄소(CO₂)와 물(H₂O), 그리고 열 에너지가 방출됩니다. - 에너지 방출:
연소 과정에서 에탄올의 화학 결합 에너지가 열과 빛의 형태로 방출됩니다. 이는 에탄올이 연료로 사용되는 이유 중 하나입니다.
에탄올 연소 반응의 특징 🌿
- 완전 연소:
산소가 충분히 공급되면 이산화탄소와 물이 주 생성물이 됩니다. - 불완전 연소:
산소가 부족하면 일산화탄소(CO)나 그을음(탄소)이 형성될 수 있습니다. - 청정 연료:
에탄올은 비교적 낮은 탄소 배출량을 자랑하며, 환경친화적인 연료로 여겨집니다.
실험적 관찰 및 주의사항 🧪
실험 과정:
에탄올을 작은 용기에 담고 불을 붙이면 밝은 불꽃이 생성됩니다. 이때 열과 함께 이산화탄소와 수증기가 방출됩니다.
주의사항:
- 환기: 연소 실험 시 이산화탄소와 수증기가 배출되므로, 환기가 잘 되는 환경에서 진행하세요.
- 안전 장비: 화학 실험 중에는 안전 고글과 장갑을 착용하여 화재 및 부상을 예방하세요.
에탄올 연소의 실용성 🚗
에탄올은 다양한 산업에서 사용되는 중요한 연료입니다.
- 자동차 연료:
에탄올은 자동차 연료로 사용되며, 환경 오염을 줄이는 대체 에너지로 주목받고 있습니다. - 가정용 연료:
청정 에너지원으로서 가정용 난로 및 조리 기구에도 사용됩니다. - 에너지 산업:
바이오에탄올은 재생 가능한 에너지로, 화석 연료를 대체할 수 있는 가능성을 보여줍니다.
저의 경험담 ✍️
제가 처음 에탄올 연소 반응을 관찰했던 실험이 아직도 기억에 남습니다. 작은 비커에 담긴 에탄올에 불을 붙였을 때, 환한 불꽃과 함께 따뜻한 열이 느껴졌습니다. 이 실험을 통해 화학이 얼마나 실용적이고 매력적인 학문인지 느끼게 되었습니다. 🔥
지금은 블로거로서 과학적 지식을 더 많은 사람들과 공유하며, 과학이 주는 재미와 가치를 전하고 싶습니다. 여러분도 에탄올 연소 반응의 원리를 이해하며 에너지의 중요성을 느껴보세요! 😊
요약:
에탄올 연소 반응은 간단한 화학 반응이지만, 우리 삶에서 큰 영향을 미칩니다. 에탄올은 청정 연료로, 환경 보호와 에너지 산업에서 중요한 역할을 하고 있습니다. 이 반응을 이해하며 화학의 원리를 배워보세요! 🌿